Ces contrôles visent à démontrer l’absence de contamination par des bactéries en montrant la pureté du levain et que celui-ci correspond bien à Saccharomyces cerevisiae, en étudiant ses caractéristiques morphologiques et biochimiques. Une fois la souche validée, il est nécessaire de vérifier ses capacités de croissance : pour cela on déterminera ses paramètres cinétiques de croissance de façon à vérifier qu’elle est apte à se développer dans le cadre d’une bioproduction.
Démarche mise en œuvre
A partir d’une suspension de levain, on réalise successivement :
un ensemencement sur gélose Sabouraud (pour vérifier la pureté de la souche),
un ensemencement d’une galerie API 20C AUX (pour vérifier ses caractéristiques biochimiques),
une observation au microscope optique du levain (pour vérifier ses caractéristiques morphologiques).
un test de développement en fermenteur de laboratoire (pour déterminer les paramètres cinétiques).
un test de résistance aux levures « killer » (pour vérifier la non sensibilité du levain aux contaminants extérieurs).
Ensemencement sur gélose Sabouraud :
L’ensemencement est réalisé par isolement sur un milieu gélose en boîte de Pétri.
Voir ci-dessous une vidéo de la technique d’ensemencement d’une gélose en boîte de Pétri :
Après incubation 24h à 30°C :
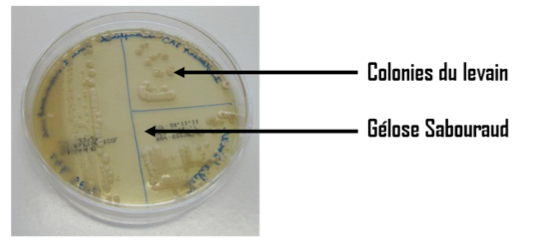
L’observation macroscopique des colonies montre la présence d’un seul type de colonies présentant les caractéristiques suivantes : couleur blanchâtre et aspect bombé et crémeux. Sur gélose Sabouraud, ces caractères sont représentatifs des levures. De plus, une odeur de levures de brasserie et/ou de boulanger confirme l’analyse. La souche est pure.
Observation au microscope optique :
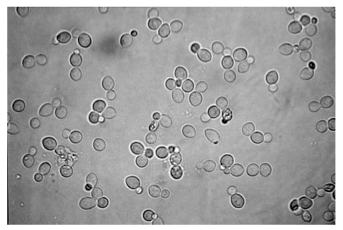
L’observation du levain montre la présence de cellules de forme ovoïde avec des bourgeonnements. Ces deux éléments montrent respectivement qu’il s’agit de levures et qu’elles sont dans une dynamique de croissance.
Ensemencement d’une galerie API 20C AUX
La galerie API 20C AUX constitue un outil permettant de vérifier l’identité d’une levure en étudiant ses caractères biochimiques.

Téléchargez la fiche d’utilisation de la galerie API 20C Aux (source : Bio-Mérieux)
Voir ci-dessous une vidéo de l’utilisation d’une galerie API :
La galerie API 20C AUX comporte 20 tests où chaque cupule permet d’étudier l’auxotrophie de la souche vis à vis d’un glucide présent dans la cupule.
Définition de l’auxotrophie : aptitude d’un micro-organisme à se développer en présence d’une source unique de carbone (ici un glucide).
La lecture des différents tests ( + : culture possible en présence du glucide, - : incapacité de la souche à se développer uniquement avec se glucide) permettent d’obtenir un profil, dont les résultats, une fois exploités sur une base de données permettent d’obtenir la correspondance avec le nom du levain.
Exemple de résultats obtenus à l’aide de la base de données en ligne Apiweb :
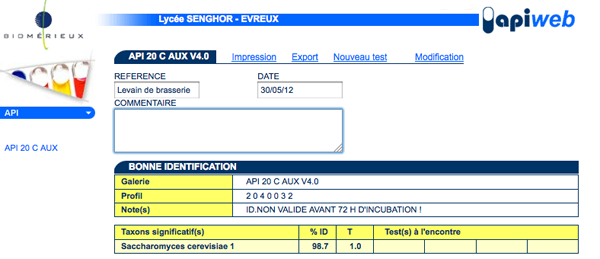
Le résultat obtenu confirme qu’il s’agit effectivement de la souche Saccharomyces cerevisiae avec une bonne fiabilité de l’identification (98,7%) et une bonne typicité (T=1) de la souche (c’est à dire une bonne correspondance entre le profil de notre souche et le profil théorique connu pour cette souche).
Conclusion : Le levain est une souche pure présentant une morphologie et des caractères biochimiques typiques de Saccharomyces cerevisiae.
Vérification des paramètres cinétiques de croissance
Le contrôle des paramètres cinétiques de la souche de levure décongelée, constitue une étape importante pour l’industriel. En effet, pour lui assurer des rendements convenables, le levain doit présenter un temps de génération convenable (le temps de génération est le temps nécessaire pour doubler le nombre de levures lors de leur croissance). On réalisera donc une étude complète de la croissance du levain en fermenteur.
Les fermenteurs de laboratoire sont des enceintes, généralement en verre permettant la croissance de micro-organismes, en contrôlant différents paramètres (agitation, température, pH, oxygénation).
Exemple de fermenteur de laboratoire :

Démarche mise en œuvre :
Une cuve de fermentation de 10 litres est ensemencée avec Saccharomyces cerevisiae dans un milieu analogue à celui utilisé pour fabriquer la bière (moût de fermentation à base de malt). On dénombre les levures au cours du temps au fur et à mesure de la croissance. Par exploitation graphique et des calculs, on peut alors déterminer la vitesse spécifique de croissance (Qx) et le temps de génération (G).
Voir l’animation ci-dessous pour modéliser les résultats d’une courbe de croissance en fermenteur (cocher graphe ln X = f(t), puis cliquez sur « Démarrer »)
Source : http://www.biomultimedia.net
Exemples de résultats obtenus avec le levain et interprétation :
Courbe de croissance : ln N levures/mL = f (t en minutes)
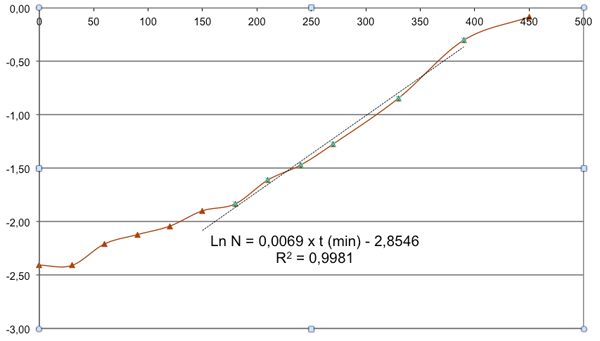
La phase exponentielle de croissance (ici surlignée en pointillés) est la zone permettant une exploitation numérique de résultats. L’équation de la droite en phase exponentielle, nous permet de déterminer la vitesse spécifique de croissance Qx.
Ici, après exploitation de ces résultats, on obtient :
Qx (correspondant au coefficient directeur) = 0,0069 min-1
soit un G = ln 2/Qx = ln 2 / 0,0069 = 100 min
Notre levain présente donc un temps de génération de 100 min, c’est le temps qu’il met pour doubler sa population. Ce temps de génération est satisfaisant au regard des exigences de productivité.
Conclusion : Les paramètres cinétiques du levain étudié sont convenables et permettront d’obtenir un rendement de production convenable pour la brasserie.
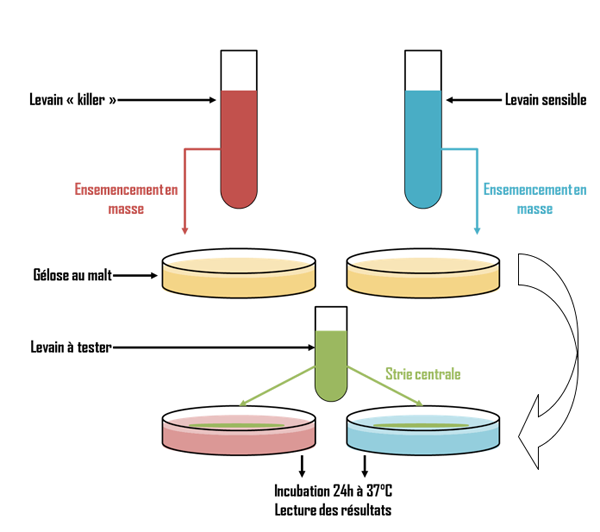
Vérification de la sensibilité aux levures « killer »
Les levains de brasserie peut-être soumis à diverses contaminations extérieures, notamment par des levures dites « killer » qui peuvent détruire les levains et ainsi nuire à une bioproduction.
Les levures de brasserie peuvent être classées en 3 catégories :
les levures « killer » qui libèrent une toxine pouvant détruire les autres levures,
les levures « sensibles » qui sont tuées par cette toxine,
les levures « neutres » qui ne produisent pas de toxine et qui y sont indifférentes.
Démarche mise en œuvre :
Le protocole consiste à mettre en présence sur milieu gélosé, le levain a étudier avec d’une part une souche test reconnue sensible, et d’autre part une souche reconnue « killer ».
Le protocole est résumé dans le logigramme ci-dessous :
Résultats obtenus et interprétation :
Les résultats des deux tests figurent ci-dessous :
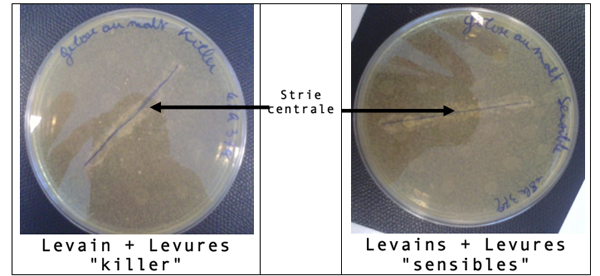
Levain + Levures « killer » :
La souche « killer » s’est développée normalement sur l’ensemble de la gélose, elle a donc libérée ses toxines. Notre levain, déposé sur la strie centrale, s’est aussi développé. Notre levain n’est donc pas sensible.
Levain + Levures « sensibles » :
Le levain sur la strie centrale s’est développé normalement, tout comme les levures « sensibles ». La croissance des levures "sensibles n’a pas été inhibée par une quelconque toxine. Notre levain ne produit donc pas de toxine.
Conclusion : Le levain de brasserie est « neutre » : il est donc très intéressant pour la réalisation de la bioproduction car sera résistant aux contaminations extérieures par les levures killer.
